При укладке в траншею изолированного трубопровода и его последующей засыпке изоляционное покрытие может быть повреждено, а в процессе эксплуатации трубопровода оно постепенно стареет (теряет свои диэлектрические свойства, водоустойчивость, адгезию). Поэтому при всех способах прокладки, кроме надземной, трубопроводы подлежат комплексной защите от коррозии защитными покрытиями и средствами электрохимической защиты (ЭХЗ) независимо от коррозионной активности грунта.
К средствам ЭХЗ относятся катодная, протекторная и электродренажная защиты.
Защита от почвенной коррозии осуществляется катодной поляризацией трубопроводов. Если катодная поляризация производится с помощью внешнего источника постоянного тока, то такая защита называется катодной, если же поляризация осуществляется присоединением защищаемого трубопровода к металлу, имеющему более отрицательный потенциал, то такая защита называется протекторной.
Катодная защита
Принципиальная схема катодной защиты показана на рисунке.
Источником постоянного тока является станция катодной защиты 3, где с помощью выпрямителей переменный ток от вдольтрассовой ЛЭП 1, поступающий через трансформаторный пункт 2, преобразуется в постоянный.
Отрицательным полюсом источник с помощью соединительного провода 4 подключен к защищаемому трубопроводу 6, а положительным — к анодному заземлению 5. При включении источника тока электрическая цепь замыкается через почвенный электролит.
Что такое ингибиторы коррозии
Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла . Ингибитором коррозии может быть как одно соединение, так и смесь нескольких.
Эффективность действия ингибиторов коррозии можно оценить по двум показателям: степени защиты (Z, %) и коэффициенту торможения коррозии γ (защитный эффект ингибитора).
Формула для определения степени защиты Z:
Z = [(K1– K2)/K1]•100 = [(i1 – i2)/i1]•100,
где K1, K2 – скорость коррозии (растворения) металла в среде без ингибитора и с ним [г/(м2•ч)];
i1, i2 – плотность коррозионного тока в неингибируемой среде и ингибируемой, соответственно [А/см2].
Значение Z равно 100% тогда, когда металл полностью защищен, скорость коррозии сводится к 0.
Защитный эффект ингибитора рассчитывается по формуле:
γ = K1/K2 = i1/i2.
Коэффициент торможения показывает, во сколько раз под действием ингибитора уменьшается скорость коррозии.
Между коэффициентом торможения и степенью защиты существует связь, определяющаяся формулой:
Z = (1 – 1/ γ)•100.
Принципиальная схема катодной защиты
1 — ЛЭП; 2 — трансформаторный пункт; 3 — станция катодной защиты; 4 — соединительный провод; 5 — анодное заземление; 6 — трубопровод
Принцип действия катодной защиты следующий. Под воздействием приложенного электрического поля источника начинается движение полусвободных валентных электронов в направлении «анодное заземление — источник тока— защищаемое сооружение». Теряя электроны, атомы металла анодного заземления переходят в виде ион-атомов в раствор электролита, т.е. анодное заземление разрушается. Ион-атомы подвергаются гидратации и отводятся в глубь раствора. У защищаемого же сооружения вследствие работы источника постоянного тока наблюдается избыток свободных электронов, т.е. создаются условия для протекания реакций кислородной и водородной деполяризации, характерных для катода.
Подземные коммуникации нефтебаз защищают катодными установками с различными типами анодных заземлений. Необходимая сила защитного тока катодной установки определяется по формуле
Jдр=j3·F3·K0
где j3 — необходимая величина защитной плотности тока; F3 — суммарная поверхность контакта подземных сооружений с грунтом; К0 — коэффициент оголенности коммуникаций, величина которого определяется в зависимости от переходного сопротивления изоляционного покрытия Rnep и удельного электросопротивления грунта рг по графику, приведенному на рисунке ниже.
Необходимая величина защитной плотности тока выбирается в зависимости от характеристики грунтов площадки нефтебазы в соответствии с таблицей ниже.
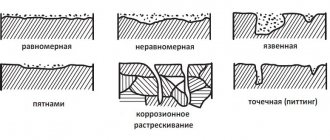
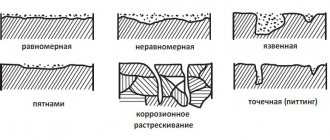
Защита от коррозии
Защита от коррозии Методы защиты от коррозии можно объединить в следующие группы: 1) нанесение защитных покрытий и пленок; 2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз; 3) модификация коррозионной среды. Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия. Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия. К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины. Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны. Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме. Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры. К органическим покрытиям относятся разнообразные лакокрасочные материалы. Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию. Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается. Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора. Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока. Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость его коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава. Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик К2Сr207, вводимый в количестве 2 – 3 г/л в раствор охлаждающей жидкости. Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1 – 2 % в кислоты для снятия окалины без разрушения основного металла. Летучие ингибиторы, такие как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство, создавая защитную газовую среду. Летучие ингибиторы отличаются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2, в условиях относительной влажности 85 % не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки. Антикоррозионная защита крепежных изделий
Коррозией называется процесс разрушения металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Процесс коррозии сопровождается окислением металла и превращением его в различные химические соединения (окислы, гидроокиси, карбонаты и т. п.). Черные металлы — углеродистая сталь, чугуны — наиболее интенсивно подвергаются коррозии, тогда как многие цветные металлы, легированные и нержавеющие стали весьма устойчивы в атмосферных условиях и агрессивных средах. Все возрастающие требования к уровню долговечности и коррозионной стойкости машин и строительных конструкций, приводят к появлению более совершенных методов и технологий защиты поверхности от разрушающего воздействия окружающей среды и агрессивных эксплуатационных условий. Практически все машины, механизмы, строительные конструкции имеют в своем составе крепежные изделия, к которым предъявляются такие же требования по коррозионной устойчивости и долговечности. Применение крепежных изделий из цветных металлов, нержавеющих и легированных сталей и сплавов полностью удовлетворяют эти требования. Однако, не всегда экономически выгодно и технически возможно применение этих материалов. В связи с этим большое значение при производстве изделий и оборудования приобрели защитные металлические и неметаллические покрытия. Применение таких покрытий, предохраняющих изделия из углеродистой стали от коррозии, сокращает расход дорогостоящих металлов и сплавов и снижает стоимость конечной продукции. Типы антикорозионных защитных покрытий. По типу соединения защитного слоя с основой различают адгезионные и диффузионные покрытия. Формирование адгезионного покрытия осуществляется за счет механического сцепления частиц покрываемого слоя с шероховатой поверхностью основы. Коррозионная стойкость этих покрытий во многом определяется прочностью сцепления (адгезией) защитного слоя с основой. При формировании диффузионного покрытия на уровне разделы материала основы и материала покрытия протекают процессы диффузии и химического взаимодействия. В результате этого процесса на поверхности изделия образуется сложное по составу покрытие, связанное с основой диффузионной зоной, состоящее из атомов материала покрытия и материала основы. По типу антикоррозионной защиты различают покрытия, реализующие барьерную защиту и покрытия, реализующие электрохимическую защиту. При барьерной защите покрытие создает барьер для доступа окружающей среды к материалу основы. Очень чувствительны к механическим повреждениям. При электрохимической защите создаются сопряжения разнородных металлов с разными электродными потенциалами в данной среде эксплуатации. Для обеспечения надежной защиты от коррозии деталей используют такое покрытие, которое в паре с металлом изделия будет служить анодом. Так, для стальных изделий анодными покрытиями являются цинк, кадмий, алюминий. В случае, если в поры покрытия или в места его повреждения проникнет влага и начнется коррозионный процесс, растворению будет подвергаться не металл детали, а покрытие. Антикоррозионная защита крепежных изделий имеет свои нюансы и особенности, которые мы рассмотрим ниже. Исторически, в мировой практике сложилось так, что покрытия на основе цинка получили наибольшее распространение из-за оптимального соотношения стоимость/защитные свойства. Цинк обладает более отрицательным (на 0,2-0,3 мВ) стационарным электродным потенциалом, чем железо (сталь) и при воздействии агрессивных сред (в виде электролитов) медленно растворяется за счёт электрохимических реакций при постоянном обновлении защитных пассивных плёнок, защищая, тем самым, основной материал крепежного изделия. Таким образом, цинковое покрытие выполняет роль не только барьерной, но и электрохимической защиты. Сегодня в мире существует несколько технологий производства и нанесения цинковых покрытий. Гальванические покрытия
На сегодняшний день самой распространенной технологией нанесения цинкового покрытия на крепежные изделия является гальваническое цинкование. Гальванические покрытия наносят на поверхность стального изделия осаждением металлов при электролизе водных растворов соответствующих солей (электролитов). Процесс нанесения гальванических покрытий достаточно прост. Он заключается в том, что защищаемые изделия с подготовленной поверхностью и пластину металла, который необходимо нанести в качестве защитного покрытия, погружают в раствор солей этого металла. Покрываемое изделие служит одним электродом, а пластина осаждаемого металла – другим, между ними пропускают постоянный ток. При этом покрываемое изделие является катодом, а пластина осаждаемого металла – анодом. В процессе нанесения покрытия анод растворяется, а из раствора металл осаждается на катоде (защищаемое изделие), формируя гальваническое покрытие, толщиной от 5 до 25 мкм. Растворимый анод иногда заменяют нерастворимым (например — свинец), в этом случае необходимо поддерживать заданную концентрацию электролита. Получаемое покрытие является адгезионным. Адгезия гальванических покрытий обеспечивается молекулярными силами, действующими между молекулами цинка и основного металла. Оцинкованные изделия осветляют и пассивируют в специальных растворах,для повышения их коррозионной стойкости и улучшения внешнего вида. Оцинкованные пружины и детали, после покрытия подвергающиеся механической деформации (изгибу, развальцовке, растяжению и др.), необходимо обезводораживать на воздухе при температуре 180—200 °С в течение 2 ч. После обезводораживания цвет пассивной пленки меняется. Допускается проводить обезводораживание до осветления и пассивации. В этом случае детали после обезводораживания обрабатываются в серной кислоте (5— 15 г/л) при температуре 15—30 °С в течение 3—5 мин. Наиболее часто в промышленности и строительстве применяют покрытия стальных изделий цинком, кадмием, оловом, хромом, никелем и свинцом. На рисунке изображена микроструктура гальванического цинкового покрытия на шурупе диаметром 4 мм. Здесь видны адгезионная область (темная полоса) между основой и гальваническим покрытием и пористость. После нанесения покрытия для большей стабильности и стойкости его подвергают осветлению — активации поверхности покрытия азотной кислотой и пассивации (хроматированию) – создание дополнительного пассивного защитного слоя (его еще называют конверсионным покрытием) на поверхности самого защитного покрытия.
Пассивация может быть радужной (жёлтой), бесцветной (белой или голубой), оливковой и чёрной. При пассивации на большинстве предприятий применяют шестивалентный хром – канцероген и яд. Главные недостатки таких покрытий – потеря коррозионной стойкости при нагреве свыше 100°С и экологическая неприемлемость технологий. С начала 2007 года вышел запрет на использование шестивалентного хрома в пассивационных плёнках в автомобильной промышленности.
Замена хроматных плёнок на хромитные, не содержащие шестивалентный хром, решает обозначенные проблемы. Пассивации с трёхвалентным хромом уже применяются некоторыми производителями автомобильного крепежа, в таком варианте покрытия удовлетворяют действующие нормы по коррозионной стойкости, но оцениваются специалистами как неперспективные. Применение пассивирующих растворов и электролитов, содержащих кислоты, цианиды и другие химически активные соединения, заставляет организовывать в гальванических производствах методы нейтрализации и глубокой очистки экологически опасных отходов, строить дорогостоящие очистные сооружения, что, в конечном счете, нивелирует положительные качества высокопроизводительных процессов нанесения гальванических покрытий. Поэтому такие покрытия наряду с фосфатными, оксидными и некоторыми другими получили название конверсионных покрытий. Благодаря своим барьерным, а в некоторых случаях и электрохимическим защитным свойством, они в значительной степени повышают коррозионную стойкость гальванических покрытий. Существует большое разнообразие конверсионных пленок на цинковых покрытиях: бесцветные, радужные, оливковые, черные, которые отличаются не только внешним видом, но и коррозионной стойкостью, составом рабочих растворов, режимом обработки (рис. 2). Преимущества и недостатки Гальванические покрытия имеют ряд преимуществ и недостатков. Преимущества: • покрытие высокой химической чистоты; • электрохимическая или барьерная защита; • хорошие декоративные свойства; • возможность регулировки толщины покрытия с приемлемой точностью; • не требуют специальной подготовки резьбовых частей изделий. Недостатки: • пористость; • низкая износостойкость; • низкая долговечность; • ухудшение механических свойств крепежных изделий из легированных сталей в следствие наводораживания основного материала; • продолжительный процесс нанесения покрытий; — высокая токсичность и сложный процесс утилизации отходов. Нанесение покрытия погружением в расплав (горячее цинкование)
Способ нанесения покрытия погружением в расплав основан на диффузионном взаимодействии металла основы с расплавом металла покрытия, на границе раздела двух фаз. Формирование покрытия осуществляется при контактном взаимодействии жидкой фазы — металл покрытия с твердой фазой – металл основы. При этом на границе раздела двух фаз происходят процессы смачивания, взаимной диффузии и после извлечения покрываемого изделия из расплава, кристаллизации. Получаемые покрытия имеют сложное строение. Слой, примыкающий к стали, состоит из интерметаллических соединений металла покрытия и основы, а поверхностный слой, определяющий долговечность покрытия, из затвердевшего металла покрытия.
Технология горячего цинкования включает в себя обезжиривание стальных изделий в щелочных растворах, химическое травление в растворах кислот и флюсование, чаще всего в растворах хлоридов цинка и аммония с последующей сушкой, после этого изделия помещают в барабан и окунают в ванну (обычно керамическую) с расплавом цинка. Вращением барабана обеспечивают поток цинка относительно изделий для заполнения всех пор и микротрещин. Затем барабан вынимают из ванны и раскручивают для удаления излишков цинка методом центрифугирования. Однако на внутренней резьбе (на гайках) всё же остаются излишки цинка (рис. 4), поэтому внутреннюю резьбу протачивают повторно. Отсутствие покрытия на внутренней резьбе не влияет на коррозионную стойкость соединения, если гайка применяется с горячеоцинкованной ответной деталью – болтом или шпилькой. Благодаря высокой анодности цинка по отношению к железу при температурах до 70°С, цинк сам покрывает повреждённые участки детали со скоростью около 2 мм в год. В данном случае цинк с наружной резьбы болта благодаря разности потенциалов цинка и железа в естественной влажной и кислой среде переносится на участки внутренней резьбы гайки, оставшиеся при проточке резьбы без покрытия. Преимущества: • коррозионная стойкость в 5-7 раз превышает стойкость гальванического покрытия; • электрохимическая и барьерная защита; Недостатки: • пористость; • плохие декоративные свойства; • требуется специальная подготовка резьбовых частей изделий; • большая, в сравнении с гальваническим покрытием, толщина покрытия 40-60 мкм; • низкая износостойкость; • возможно ухудшение механических свойств крепежных изделий из легированных сталей вследствие воздействия высоких температур; • продолжительный процесс нанесения покрытий; • высокая токсичность и сложный процесс утилизации отходов.
Защитное антикоррозионное покрытие Delta-MKS® (цинк-ламельное).
Цинк-ламельные покрытия относятся к типу неэлектролитических покрытий с использованием мелкодисперсного цинка и электропроводящего связующего. Название данного покрытия происходит от его наполнителя – дисперсного цинка, который представлен в виде мелких чешуек(ламелей) толщиной в несколько десятых долей микрона, с шириной (длиной) составляющей 20÷30 мкм. Одной из самых известных в мире и при этом представленной на рынке Украины является немецкая технология нанесения цинковых дисперсных антикоррозионных систем Delta-MKS®. Защитная система цинк-ламельных покрытий Delta-MKS® состоит из базового слоя и дополнительного изолирующего слоя, который наряду с антикоррозионной защитой металлических изделий обеспечивает дополнительные свойства – фрикционные, упруго-пластичные, тепловые, химически стойкие, механические, декоративные и др. Базовый слой – это электропроводящая матрица неорганического происхождения (лак) с параллельно расположенными в ней чешуйками цинка прошедшими пассивацию без использования хрома Cr(VI). Базовый слой, благодаря электропроводности и наличию дисперсного цинка, по отношению к защищаемой поверхности стальной детали является анодом, так как электродный потенциал цинка по величине более электроотрицателен, чем электродный потенциал железа (стали), реализуется процесс катодной защиты. Таким образом, при внешнем механическом повреждении покрытия вначале подвергаются коррозии цинковые частицы. И только после полной коррозии цинка, начинает коррозировать стальная деталь. Толщина базового слоя может находится в диапазоне 5÷10 мкм. Дополнительный защитный слой – это лак органического происхождения на основе растворителей (высоко сетевой полимер), нанесенный на базовый слой. Фактически это дополнительная антикоррозионная защита катодного типа с электроизоляционными свойствами. Этот дополнительный слой защищает базовый от возникновения «белой коррозии» — коррозии цинка, изолируя от воздействия окружающей среды. Кроме того, дополнительный слой позволяет окрашивать поверхности деталей в широком спектре цветов и может являться носителем интегрированной смазки, позволяющей регулировать коэффициент трения в резьбовых соединениях. Толщина финишного слоя может находится в диапазоне 3÷5 мкм.
Технология нанесения
Условные обозначения
Технология нанесения покрытий Delta-MKS® включает в себя такие основные этапы: • Подготовительный — поэтапная промывка в водных растворах моющих средств с последующей дробеструйной обработкой для активации поверхностного слоя изделий. • Нанесение покрытия — цикличное погружение крепёжных изделий в раствор с последующим центрифугированием, благодаря чему удаляются излишки раствора на изделиях. • Термическая обработка — предварительный подогрев до температуры 60–80° С. Выдержка покрытых крепёжных изделий в проходной печи при температуре 180–250° С. • Охлаждение — принудительное охлаждение и выгрузка. Процессы можно повторять несколько раз до получения требуемой толщины покрытия.
Преимущества и недостатки
Преимущества: • электрохимическая или барьерная защита; • чрезвычайно малая толщина, обычно 4 – 12 мкм; • исключено температурное влияние на материал изделий, максимальная температура при нанесении 250°C; • исключает наводораживание (насыщение водородом) поверхностного слоя изделий из высокопрочных сталей;
• привлекательный внешний вид изделий, существует возможность интеграции цвета в финишный слой; • коэффициенты трения для деталей с резьбой устанавливаются в соответствии с требованиями заказчиков, помимо этого они удовлетворяют прочим свойствам болтовых соединений • не применяют опасные для здоровья тяжёлые металлы, такие как хром (VI); • имеют высокую устойчивость к воздействию химических веществ и органических растворителей; • выдерживает от 6 до 10 циклов закручивания резьбового соединения на предельных моментах; • максимальная постоянная температура применения до 200 ˚C; • подходит для гибких и упругих элементов, таких как пружинные шайбы, шайбы Гровера, витые и тарельчатые пружины и т.д. за счет эластичности; • позволяет регулировать коэффициент трения в резьбовом соединении в пределах µ=0,09-0,18 за счет интегрированной в базовый или дополнительный слои твердой смазки. Это преимущество позволяет иметь наряду с высокоэффективной антикоррозионной защитой, стабильный коэффициент закручивания крепежных изделий, что очень важно для качественного монтажа ответственных металлоконструкций и других соединений. На наш взгляд, недостатков у данного покрытия нет. Недостатки: Низкая электропроводность соединений ввиду использования органополимерных покрытий. Ограниченный температурный диапазон применения максимум 260 ˚C. Покрытие мелких деталей. Ввиду технологических особенностей невозможно гарантировать равномерность и стабильность покрытия мелких детале, деталей с мелкой резьбой и тд. Оценивая коррозионную стойкость цинк-ламельного покрытия Delta-MKS® по методу воздействия нейтрального соляного тумана в специальных камерах (КСТ) в соответствии с требованиями ASTM (Американское общество по испытанию материалов) B117/DIN 59021 и анализируя значения по требованиям DIN 50961, получены сравнительные данные:
| № | Наименование покрытия | Время до появления коррозии, час | Ориентировочный ресурс использования покрытий в условиях города, год |
| 1. | Гальванический цинк + хроматирование, 5 мкм | 40÷45 | 2÷3 |
| 2. | Гальванический цинк + хроматирование, 8 мкм | 100÷120 | 3÷4 |
| 3. | Горячий цинк, 40÷60 мкм | 380÷400 | 10÷12 |
Протекторная защита
Принцип действия протекторной защиты аналогичен работе гальванического элемента.
Два электрода: трубопровод 1 и протектор 2, изготовленный из более электроотрицательного металла, чем сталь, опущены в почвенный электролит и соединены проводом 3. Так как материал протектора является более электроотрицательным, то под действием разности потенциалов происходит направленное движение электронов от протектора к трубопроводу по проводнику 3. Одновременно ион-атомы материала протектора переходят в раствор, что приводит к его разрушению. Сила тока при этом контролируется с помощью контрольно-измерительной колонки 4.
Методы защиты трубопроводных магистралей
Коррозия трубопроводов возникает в процессе их эксплуатации. Образование ржавчины происходит на трубах внутри и снаружи. C внутренней стороны появляются отложения, и причина этому — химические реакции состава транспортируемой жидкости с металлом. На состояние поверхности оказывает влияние и высокий показатель влажности грунта.
Если своевременно не обеспечить защиту, то возможно возникновение ряда последствий. Что важно:
- плановые осмотры рекомендуется проводить с небольшими временными промежутками.
- проведение ремонтных работ осуществлять периодически, независимо от наличия коррозии.
- приостановление функционирования трубопроводного транспорта неминуемо, так как необходимо производить осмотры и выполнять планово-предупредительные и иные текущие ремонты.
Важно! Для обеспечения полной защиты необходимо учитывать способ монтажа, контактирование с агрессивными средами, а также тип трубопровода.
Зависимость защитной плотности тока от характеристики грунтов
| Тип грунта | рп Омм | А, А/м2 |
| Влажный глинистый грунт: | ||
| — pH >8 | 15 | 0,033 |
| pH = 6-8 | 15 | 0,160 |
| — с примесью песка | 15 | 0,187 |
| Влажный торф (pH <8) | 15 | 0,160 |
| Увлажненный песок | 50 | 0,170 |
| Сухой глинистый грунт | 100 | 0,008 |
Классификация ингибиторов коррозии
По типу среды ингибиторы коррозии различают:
— ингибиторы нейтральных коррозионных сред;
— атмосферной коррозии;
— ингибиторы кислых сред;
— сероводородной коррозии;
— ингибиторы нефтяных сред.
В разных коррозионных средах один и тот же ингибитор может вести себя совершенно по-разному.
Классификация ингибиторов коррозии по механизму действия:
— пассивирующие ингибиторы;
— адсорбционные ингибиторы.
По характеру защитного действия различают ингибиторы анодные, катодные, смешанные.
По химической природе ингибиторы делятся на: летучие, органические, неорганические.
Адсорбционные ингибиторы коррозии адсорбируются на поверхности защищаемого изделия, образуя пленку, и тормозят электрохимические реакции. Иногда достаточно образование тонкой мономолекулярной пленки. Адсорбционными ингибиторами чаще всего являются ПАВ (поверхностно-активные вещества), а также органические соединения. При воздействии на изделие они дополнительно усиливают защитные свойства оксидной пленки. Поэтому можно сделать вывод, что наличие в коррозионной среде кислорода способствует увеличению защитного эффекта адсорбционных ингибиторов коррозии. Если же оксидная пленка неустойчива — затрудняется адсорбция ингибитора на поверхности металла, кислород дополнительного влияния не оказывает.
Пассивирующие ингибиторы коррозии играют важную роль при образовании на поверхности металла защитной пленки, которая пассивирует ее. В роли пассиваторов чаще всего выступают неорганические соединения, обладающие окислительными свойствами (нитриты, молибдаты, хроматы). При обработке поверхности этими веществами коррозионный потенциал сдвигается к положительной стороне. Пассивирующие соединения считаются более эффективными, чем большая часть непассивирующих.
Неорганические ингибиторы коррозии используются чаще всего. К ним относятся некоторые пассиваторы, катодные, анодные, пленкообразующие ингибиторы и т.д. Ингибирующий эффект таких соединений можно объяснить их составом. Некоторые анионы (PO43-, NO2—, CrO42-, SiO32-, Cr2O72-), а также катионы (Ni2+, Са2+, As3+, Sb3+, Zn2+, Bi3+) способствуют уменьшению скорости коррозионного процесса.
К неорганическим ингибиторам коррозии относятся фосфаты, бихроматы, хроматы, нитриты, полифосфаты, силикаты и т.д.
Органические ингибиторы коррозии считаются веществами смешанного действия. Они замедляю катодную и анодную реакции. Очень часто их используют при кислотном травлении. При этом различные загрязнения, ржавчина, окалина удаляются с поверхности, а основной металл не растворяется. Защитный эффект органических ингибиторов зависит от их концентрации, температуры, природы соединений.
Чаще всего в состав органических ингибиторов входит кислород, азот, сера. Они адсорбируются исключительно на поверхности металла. К органическим ингибиторам относятся некоторые летучие, амины, органические кислоты и их соли, меркаптаны (тиолы) и др.
Принципиальная схема протекторной защиты
1 — трубопровод; 2 — протектор; 3 — соединительный провод; 4 — контрольно-измерительная колонка
Таким образом, разрушение металла все равно имеет место. Но не трубопровода, а протектора.
Теоретически для защиты стальных сооружений от коррозии могут быть использованы все металлы, расположенные в электрохимическом ряду напряжений левее железа, так как они более электроотрицательны. Практически же протекторы изготавливаются только из материалов, удовлетворяющих следующим требованиям:
- разность потенциалов материала протектора и железа (стали) должна быть как можно больше;
- ток, получаемый при электрохимическом растворении единицы массы протектора (токоотдача), должен быть максимальным;
- отношение массы протектора, израсходованной на создание защитного тока, к общей потере массы протектора (коэффициент использования) должно быть наибольшим.
Данным требованиям в наибольшей степени удовлетворяют сплавы на основе магния, цинка и алюминия.
Протекторную защиту осуществляют сосредоточенными и протяженными протекторами. В первом случае удельное электросопротивление грунта должно быть не более 50 Ом-м, во втором — не более 500 Ом·м.
Электродренажная защита трубопроводов
Метод защиты трубопроводов от разрушения блуждающими токами, предусматривающий их отвод (дренаж) с защищаемого сооружения на сооружение — источник блуждающих токов либо специальное заземление, называется электродренажной защитой.
Применяют прямой, поляризованный и усиленный дренажи.
Комбинация протекторов и красок
Часто возникает необходимость защитить газопровод от коррозии не только протектором, но лакокрасочным материалом. Краска считается пассивным способом защиты от коррозионных процессов и действительно эффективна лишь, когда сочетается с применением протектора.
Такая методика сочетания позволяет:
- Уменьшить отрицательное воздействие потенциальных изъянов покрытия металлоконструкций (отслаивание, набухание, растрескивание, вспучивание и тому подобное). Такие изъяны имеются не только в результате заводского брака, но и в связи с природными факторами.
- Уменьшить (порой на весьма значимую величину) расход дорогих протекторов, при этом увеличив их срок эксплуатации.
- Сделать распределение по металлу защитного слоя более равномерным.
Также стоит отметить, что лакокрасочные составы очень часто непросто наносить на определенные поверхности уже работающего газопровода, танкера или какой-то другой металлоконструкции. В таких случаях придется обойтись только защитным протектором.
Катодные, анодные, смешанные ингибиторы
В большинстве случаев ингибиторы защищают изделие от коррозии по электрохимическому механизму, т.е. воздействуя на скорость прохождения катодного, анодного, либо обоих коррозионных процессов. Суть ингибирования заключается в замедлении этой скорости.
Анодные ингибиторы коррозии
Анодные ингибирующие добавки воздействуют на анодную реакцию. Это соединения, обладающие окислительным воздействием (нитриты, хроматы). Они способствуют образованию на анодной части металлического изделия очень тонкой пассивной пленки, которая значительно замедляет скорость коррозии на этом участке. Анодные ингибиторы называют еще пассиваторами. Механизм действия анодных ингибиторов: за счет образования пассивной пленки площадь анодной поверхности уменьшается; торможением анодного перехода основного металла в раствор.
Большинство анодных ингибиторов коррозии считается опасными, т.к. при передозировке или их недостатке в растворе может наблюдаться эффект, обратный защитному (увеличение скорости коррозии). К анодным ингибиторам относятся фосфаты, силикаты, карбонаты щелочных металлов, гидрофосфаты и многие другие. При недостаточных концентрациях в коррозионной среде анодных ингибиторов коррозии наблюдается локализация коррозионных процессов, увеличение скорости растворения металла на отдельных участках.
Катодные ингибиторы коррозии
Катодные ингибиторы замедляют катодную реакцию, растворение металла. Стационарный потенциал системы сдвигается в отрицательную сторону, идет уменьшение коррозионного тока. На поверхности образуется адсорбционная пленка. Проходит химическая реакция, в результате которой связывается деполяризатор. На поверхности защищаемого металла образуются труднорастворимые соединения, которые замедляют коррозию, блокирую поверхность. Катодные ингибирующие вещества менее эффективны, чем смешанные или анодные, поэтому их использование ограничено. Катодные, как и анодные, не применяются в кислых средах, т.к. в них малоэффективны. К ним относятся сульфит натрия, гидразин.
Ингибиторы нейтральных сред
По Розенфельду ингибиторы данного вида классифицируют так:
— с окислительными свойствами (хроматы, нитрит натрия, органические соединения, которые содержат нитро и карбоксильную группу);
— ингибиторы, которые образуют труднорастворимые соединения, но не имеют окислительных свойств (бораты, силикаты, фосфаты, карбонат натрия, гидрат натрия);
— ингибиторы со слабым окислительным действием с анионами типа (МетО4)n- (ванадаты, хроматы, вольфраматы, молибдаты).
Ниже рассмотрено несколько групп часто применяемых ингибиторов коррозии нейтральных сред.
Нитрит натрия
Самое широкое распространение среди ингибиторов нейтральных сред получил анодный ингибитор нитрит натрия NaNO2. Доступный, простой ингибитор очень часто применяется для защиты стали в воде. При повышении температуры эффективность действия нитрита натрия уменьшается, поэтому нужно повышать его концентрацию.
Очень часто нитрит натрия применяется при межоперационной защите металла. Для этого его поверхность обрабатывают 10% водным раствором ингибитора. Концентрация нитрита натрия во многом зависит от количества в воде ионов хлора. Концентрация данного вещества должна быть раз в 10 больше концентрации ионов хлора.
Нитрит натрия не применяется для защиты меди и цинка, при рН более 5.
Фосфаты
Широко применяются для ингибирования охладительных систем энергетических установок. Фосфаты – довольно сильные ингибиторы, кроме того нетоксичные. С ними обращаться нужно осторожно, чтоб не переборщить с концентрацией. Если ввести слишком большое количество – скорость коррозии наоборот увеличится. Фосфаты с продуктами коррозии образуют на поверхности стали труднорастворимые соединения, которые со временем уплотняются, изолируя поверхность. Фосфаты, как и нитрит натрия, является опасным ингибитором, т.к. если ввести его в систему в слишком малом либо большом количестве – это приведет к усилению коррозионного разрушения. Но перед нитритом натрия фосфаты имеют свои преимущества – их защитный эффект не зависит от содержания в воде хлоридов. 10 мг/л – часто используемая концентрация фосфатов для защиты стали в воде.
Хроматы
Хроматы относятся к универсальным ингибиторам, т.к. применяются для защиты почти всех металлов. Очень эффективны для ингибирования водных сред. На практике часто применяют для защиты от коррозии теплоносителей. На защитный эффект большое влияние оказывают хлор ионы, которые уменьшают действие ингибитора. Концентрация хроматов должна превышать концентрацию хлор ионов не менее, чем в 2 – 3 раза.
С повышением температуры эффективность действия хроматов сразу значительно уменьшается, требуется его большая концентрация. Например, при температуре коррозионной среды 20 °С требуется в 2 – 3 раза меньше ингибитора, чем при температуре 80 °С. Если при повышенной температуре в коррозионной среде содержится недостаточное количество ингибирующих добавок – коррозия носит локальный характер.
Немного более эффективными считаются хроматы на органической основе (метиламина, циклогексиламина, изопропиламина, гуанидина).
Хроматы применяются только для защиты металла в оборотной воде.
Среди ингибиторов нейтральных сред можно выделить: ОЭДФ, НТА, ФБТК, ЭДТА, НТФ. Эти комплексные ингибиторы (комплексоны) хорошо защищают изделие лишь в жесткой воде, образуя соединения с катионами магния, кальция.
Для мягких вод больше подходят ингибиторы ИФХАН-31 и 34, которые отлично защищают системы, состоящие из различных металлов и сплавов.
Ингибиторы коррозии для газо- и нефтепромышленности
Наличие в нефти различных примесей, растворенного сероводорода делает ее очень агрессивной коррозионной средой. Ингибирование применяют на всех стадиях добычи, переработки, хранения нефти. При этом используется одно и то же вещество. Большинство ингибирующих добавок образуют на поверхности металла пленку, гидрофобизируют ее. В нефть также вводятся ингибиторы парафинообразования, антивоспениватели, антивоспламенители. Для защиты металла от сероводородной коррозии (газо-, нефтепромышленность) хорошо себя зарекомендовали ингибирующие добавки на аминной основе.
Распространенные ингибирующие добавки в газо- и нефтепромышленности: типа ИФХАНгаз, сульфанол П, АМДОР-ИК, Олазол-Т2П, Корексит-6350, ИСА-148, Сепакор 5478, Додиген 4482-1, т.д.